
酶制剂冷冻干燥的挑战:
如何锁住100%活力
生物制品如蛋白质、酶和抗体在溶液状态下容易受到物理降解(如变性、聚集)和化学反应(如氧化、水解)的影响,导致其结构和功能不稳定[1]。随着生物技术的迅速发展,越来越多的生物制品开始采用冷冻干燥技术(Lyophilization)以延长其保存期限和提高运输便利性。这一方法通过将物质中的水分直接从固态升华成气态而去除,从而能够在不破坏产品结构的情况下,保留样品原有的生物活性,实现长期稳定保存。
然而在实际冷冻干燥过程中,对于酶这类对环境条件极为敏感的生物活性分子来说,可能会受到多种不利因素的影响,包括低温应力[2]、浓度效应[3]、pH 值变化[4]、相分离[5] 和脱水应力,导致蛋白质结构的可逆或不可逆变化,从而影响活性。如何确保冻干前后酶活性的有效保持成为了亟待解决的技术难题之一。此外,即便是在理想的储存条件下,酶制剂在放置过程中仍面临着活性逐渐丧失的风险,这不仅影响了产品的最终效果,也增加了生产成
本。

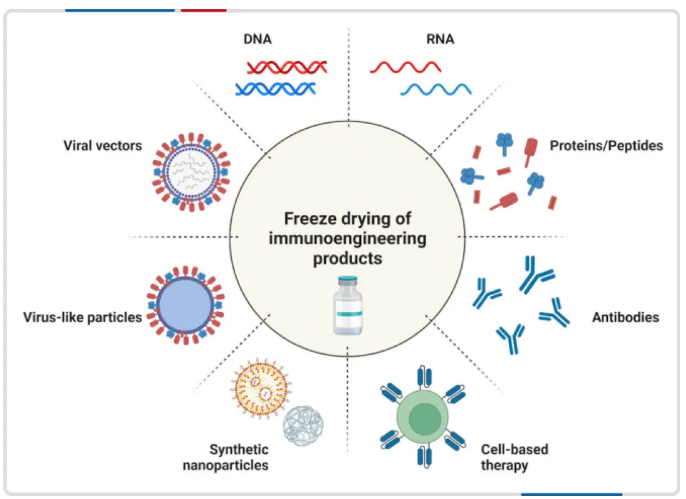
图注:冷冻干燥技术应用的广泛性

影响酶制剂冻干活性与
稳定性的关键因素
冻干工艺的关键参数:解锁最佳的路径
冷冻干燥主要包括预冻、退火、一次干燥和二次干燥等关键阶段。精确调控每个步骤的条件及参数,对于确保酶制剂在冻干后的生物活性和稳定性至关重要,这其中预冻阶段的冻结温度、一次干燥阶段的崩解温度和加热速率和二次干燥阶段的温度和时间尤为重要。
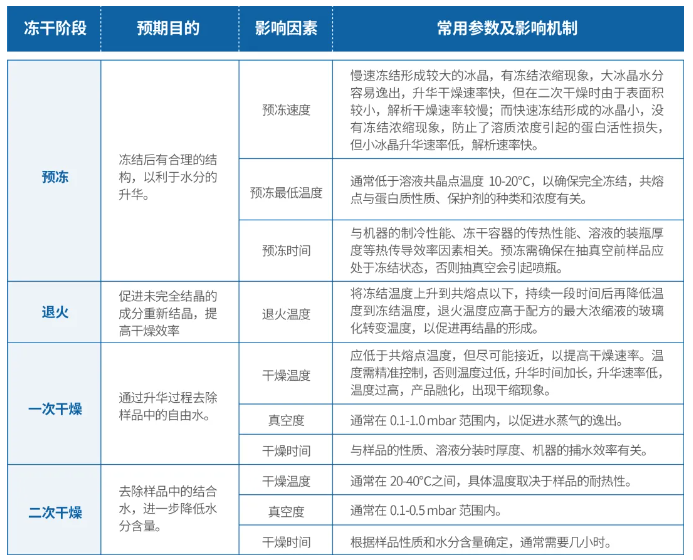
图注:冻干各个环节中的影响因素
● 冻干参数关键点I:冻结温度
冻结温度决定了冰晶的形成和大小。适当的冻结温度可以形成细小均匀的冰晶,有助于提高升华效率并减少对生物分子结构的损伤。冻结温度应低于共晶点 10-20℃,以确保所有溶质完全固化。
James A 等[6] 通过控制成核温度和速率,改善了样品成核时的不均匀性,在提升样品稳定性的同时使初始干燥效率提高了 3.5 倍。
● 冻干参数关键点II:一次干燥阶段的崩解温度和加热速率
崩解温度是干燥层温度达到某一临界值时,固体基质的刚性不足以维持蜂窝状结构,导致空穴壁塌陷的温度。控制干燥温度低于崩解温度可以防止结构塌陷,确保升华过程顺利进行。可采用差示扫描量热法(DSC)或其他方法测定崩解温度,并确保一次干燥阶段的温度低于该温度。下图为人血白蛋白在冻干过程中,由于温度升高结构逐渐塌陷的内部显微结构[7]。

图注:人血白蛋白在冻干过程的显微剖面图
A:样品与空气/液体界面冷冻(1*),B:干燥界面沿着前沿推进(2*),C:温度升高,前沿塌陷(3*)及表面破裂(4*)
加热速率则影响水分的升华速度和均匀性。过快或不均匀的加热会导致局部过热,从而破坏样品结构。缓慢且均匀的加热有助于水分均匀升华,避免局部过热。
● 冻干参数关键点III:二次干燥阶段的温度时间
二次干燥阶段用于去除残留的结合水,彻底干燥样品。设定适当的温度(高于一次干燥温度但低于样品耐受温度)和足够的时间以彻底去除残留水分,可以确保样品完全干燥,同时避免过度干燥导致样品变性。
制剂配方的魔法:保护剂如何在冻干工艺中发挥作用
冻干保护剂在冷冻干燥过程中发挥着多重的作用,它们能够防止物理损伤和化学降解、保持生物制品(如酶、蛋白质和抗体)的稳定性和活性,增强样品的重构能力。冻干保护剂的选择原则通常包括玻璃化转变温度(Tg)、水置换能力、保持结构稳定性的能力和增强重构等能力,此外根据具体应用场景还需要考虑抗氧化能力、化学稳定性、生物相容性和成本效益等因素。

图注:常用保护剂及保护机制
其中 Tg 是指保护剂从橡胶态转变为玻璃态的温度,在冷冻干燥后蛋白质的稳定性方面起着至关重要的作用。选择具有较高 Tg 的保护剂,如海藻糖、蔗糖等,可以确保样品在一次干燥阶段保持玻璃态,防止蛋白质在储存过程中的变性和降解,从而维持结构完整性。


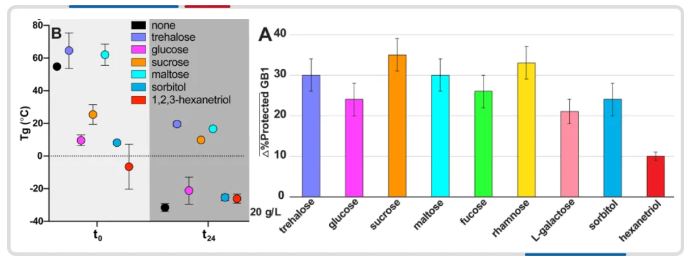
图注:GB1 蛋白与各类保护剂混合物 Tg 值与冻干后活性保存率的关系[8]
糖类和多羟基化合物是最常见、使用最广泛的一类冻干保护剂,其中二糖是最有效的保护剂,尤其是蔗糖和海藻糖[9],这是由于它们具有较高的高玻璃化转变温度(Tg)和良好的水置换能力和结构稳定性。Jovanović Natasa 等[10] 通过扫描电镜观察肌红蛋白和溶菌酶在冻干过程中的颗粒形态,发现未添加保护剂时颗粒形态受到冻干应力的影响而变化,而蔗糖和海藻糖能够有效保护颗粒形态不受影响。
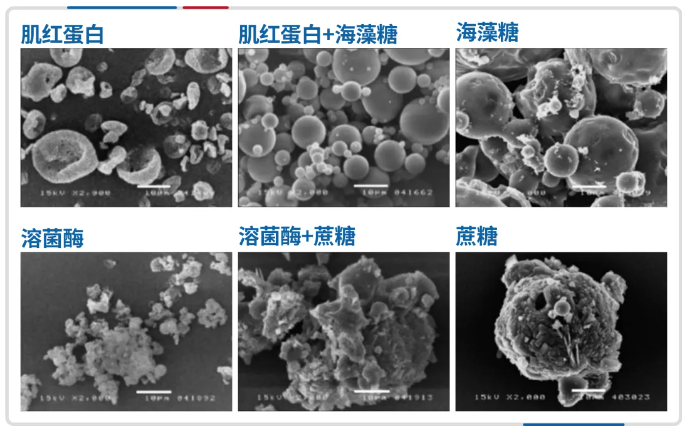
图注:蔗糖和海藻糖能够保护肌红蛋白和溶菌酶在冻干过程中的蛋白颗粒形态
通过微观的改变进而保持冻干过程酶的活力及稳定性,Kawai Kiyoshi 等[11] 将四种二糖作为乳酸脱氢酶的冻干保护剂,有效减少了乳酸脱氢酶在冻干过程的活力损失,同时提升了在长期储存的稳定性。
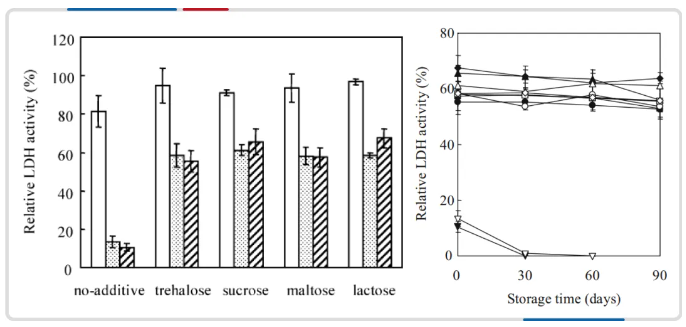
图注:二糖作为保护剂能够提升乳酸脱氢酶冻干过程和储存过程中的稳定性
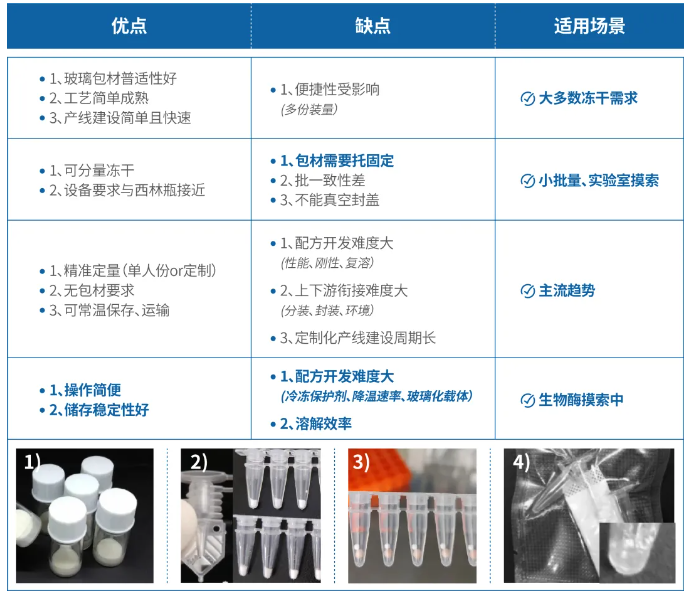
酶制剂冻干工艺开发思路
冻干工艺的开发是一个系统而复杂的过程,涉及共晶点测试、崩解温度测试、升华速率测试、冻干保护剂筛选等多个步骤,需要综合关键影响因素的分析,进行系统的实验设计,才能得到良好的冻干工艺。
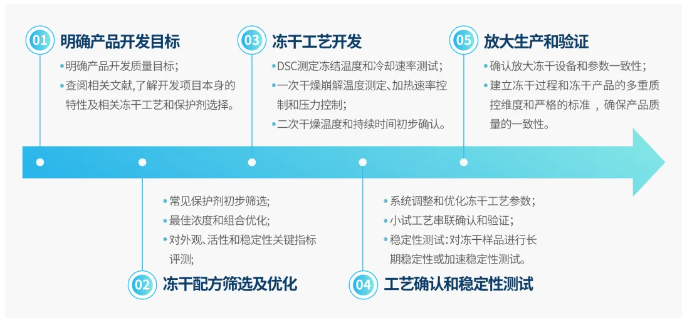
图注:冻干产品的开发流程
在瀚海新酶某生化诊断酶原料开发中,由于溶质和样品混合液的崩解温度低,且混合液浓度较低,冻干后的产品出现表面塌陷、非一致性分散,无法形成良好的冻干粉饼形态;更为棘手的是在只含有缓冲剂成分冻干后酶活力和冻干粉 37℃ 热稳孵育过程均出现大幅度下降(配方 1.0)。
产品塌陷的问题主要是由于一次干燥温度高导致,因此降低干燥温度后可解决,但是想要形成蜂窝结构及保持酶的稳定性,则需要进行保护剂的筛选和组合。在初步筛选中,通过评估其对酶活性的保护效果,获得了优势的冻干保护剂:配方 1.5 和配方 1.6;进一步将配方 1.5 和 1.6 进行组合和浓度优化,经过3轮测试,最终获得冻干活力高且热稳定性好的最佳配方 3.4。同时通过优化一次干燥温度→保护剂筛选→冻干缓冲液配方最终得到了良好的冻干外观。

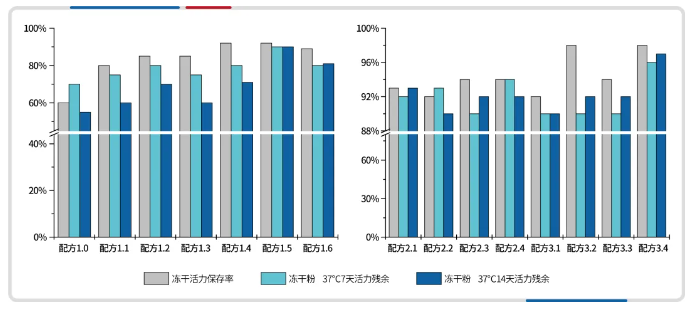
图注:冻干保护剂对酶活力的影响


Step1:由于一次干燥温度过高,超过崩解温度,出现产品塌陷的现象。
Step2:优化干燥温度,解决塌陷问题,但产品出现非一致性分散,主要原因是冻干结构刚性差,无法形成良好的蜂窝状结构。
Step3:通过保护剂的筛选,改善了冻干形态,但由于样品与西林瓶存在高表面张力,出现产品爬壁现象。
Step4:调整冻干配方,改善溶液表面张力,获得良好冻干品相的优势工艺。
瀚海新酶冻干产品
和冻干开发平台
PCR可冻干试剂
PCR 冻干试剂是指将 PCR 反应所需的各种组分(包括 DNA 聚合酶、逆转录酶、dNTPs、MgCl₂、缓冲液和引物等)进行冻干处理,制备成稳定的粉末状/冻干球制品。加水复溶后,即可直接进行PCR反应。与传统的液态 PCR 试剂相比,冻干试剂稳定性强,便携性、易用性高且可适配自动化设备,大大拓展了PCR技术在病原体快速诊断、基因检测、法医鉴定等领域真实场景的应用范围。

瀚海新酶提供 MS qPCR/RT-qPCR 可冻干预混液,支持加引探冻干,后续使用时直接加入样本核酸即可;支持单重/多重检测;使用 UDG-dUTP 防污染体系,能有效防止扩增产物气溶胶污染的风险。
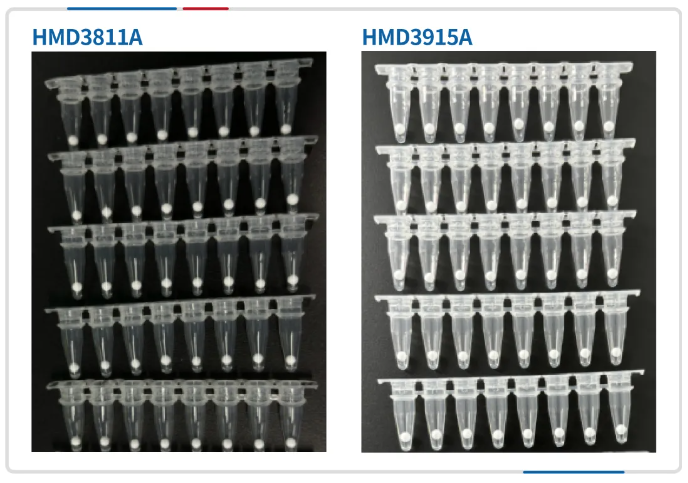
qPCR预混液冻干球产品展示


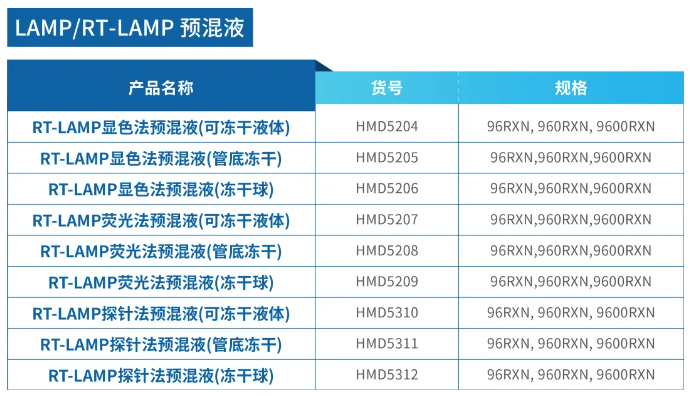
LAMP可冻干试剂及定制化服务
LAMP 冻干试剂是指将 LAMP 反应所需的各种组分(包括 Bst 酶、逆转录酶、dNTPs、MgCl₂、缓冲液和引物等)进行冻干处理,制备成稳定的粉末状/冻干球制品。加水复溶后,即可直接进行 LAMP 扩增反应。与传统的液态 LAMP 试剂相比,冻干试剂稳定性强,便携使用便携,可常温储存,大大降低了冷链运输成本。
瀚海新酶提供:LAMP/RT-LAMP 可冻干预混液及冻干产品,也提供定制化的 CRO/CDMO 冻干服务,针对客户多样化需求为客户定制特殊需求的冻干产品。

冻干校准质控品
瀚海新酶创新性地采用动物源血基质来制作糖化血红蛋白校准质控品,成本低廉且获取容易,适合大批量生产,有助于工业化生产;使用者可以一次订购1年或以上的量,避免频繁地更换靶值和控图。在提高血红蛋白校准质控品的产量的同时,有效地规避了生物安全问题及进出口法规风险。

糖化血红蛋白(HbA1c)校准质控品
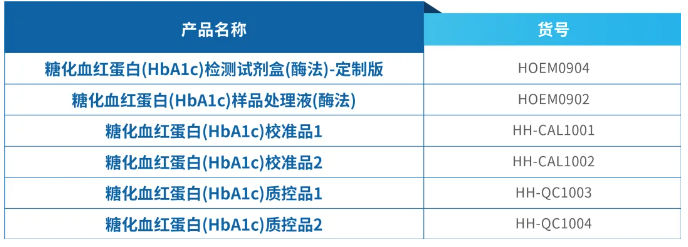
冻干CMO服务
瀚海新酶作为特种酶行业领先者,拥有丰富的重组蛋白产品开发和生产经验,擅长大肠杆菌和酵母菌表达体系,经过长期的项目研发、核心技术积累以及产业化深耕,我们搭建了超净酶的纯化平台和丰富的冻干制剂开发技术,可提供 0.4m2-0.5m2-2m2-10m2-20m2不同规模冻干平台,可匹配小试-中试-产业化各个阶段的生产需求。
瀚海重组蛋白业务详情:技术分享 | 瀚海新酶重组蛋白定制一站式服务-重组蛋白产业化的最佳选择


专属福利 免费领好书!
瀚海新酶期待与行业大众就特种酶智造相关技术进行分享讨论,以《瀚海酶谈》为主题,推出连载专题。前期已推出连载专题第一期《特种酶的智造》—“酶之舞,需编之”(点击阅读),第二期《“粮草先行” !探寻大肠杆菌高密度发酵培养基的奥秘》(点击阅读),第三期《精准诊断的关键:打造超洁净分子酶——核酸残留的清除秘籍!》(点击阅读)。
本期推出《瀚海酶谈》连载专题第四期,后续将对制剂工艺开发、酶的性能表征等方面相关技术进行专业分享与讨论,请持续关注,敬请期待!


【 活动时间 】
即日起-2025.1.20
【 参与方式 】
1. 关注:瀚海新酶公众号

瀚海新酶生物科技
生物医药原料、疫苗制备原料、体外诊断试剂原料、生物试剂定制研发
56篇原创内容
公众号
*后续多期《瀚海酶谈》专题文章推出,请持续关注!
2. 对话框输入:冻干,根据提示完成登记。
3. 添加官方微信,及时了解活动详情,备注验证:冻干

【 获奖说明 】
登记信息后,内部审核符合审核条件的 8 位幸运读者,将获专业书籍一本,7 个工作日内联系获奖寄送。
【 参与对象 】
截止目前,未在其他平台参与过本活动的行业内医学科研院所生物技术从业人员、相关专业诊断、检测应用人员
*本活动最终解释权归武汉瀚海新酶生物科技有限公司所有。
参考文献
[1] Wei Wang. Lyophilization and development of solid protein pharmaceuticals[J]. International Journal of Pharmaceutics, 2000, 203(1-2):1-60.
[2]Edi Gabellieri, Giovanni B. Strambini. Perturbation of Protein Tertiary Structure in Frozen Solutions Revealed by 1-Anilino-8-Naphthalene Sulfonate Fluorescence[J].Biophysical Journal,2003,85(5):3214-3220.
[3]Ken-Ichi Izutsu, Yasuto Fujimaki, Akiko Kuwabara, Nobuo Aoyagi. Effect of counterions on the physical properties of l -arginine in frozen solutions and freeze-dried solids[J]. International Journal of Pharmaceutics, 2005, 301(1-2):161-169.
[4]Benjwal Sangeeta, Jayaraman Shobini, Gursky Olga. Electrostatic effects on the stability of discoidal high-density lipoproteins[J]. Biochemistry, 2005, 44 (30):10218-26.
[5]Heller MC, Carpenter JF, Randolph TW. Application of a thermodynamic model to the prediction of phase separations in freeze-concentrated formulations for protein lyophilization[J]. Arch Biochem Biophys, 1999, 363(2):191-201.
[6]James A. Searles, John F. Carpenter, Theodore W. Randolph. Annealing to optimize the primary drying rate, reduce freezing‐induced drying rate heterogeneity, and determine T ' g in pharmaceutical lyophilization[J]. Journal of Pharmaceutical Sciences, 2001, 90(7): 872-887.
[7]Matejtschuk P. Lyophilization of proteins. Methods Mol Biol. 2007, 368:59-72.
[8]Brom Julia A, Petrikis Ruta G, Pielak Gary J. How Sugars Protect Dry Protein Structure[J]. Biochemistry, 2023, 62 (5).
[9]S. Dean Allison, Thomas J. Anchordoquy. Mechanisms of Protection of Cationic Lipid‐DNA Complexes During Lyophilization[J]. Journal of Pharmaceutical Sciences, 2000, 89 (5): 682-691.
[10]Jovanović Natasa, Bouchard Andréanne, Hofland Gerard W, Witkamp Geert-Jan, Crommelin Daan J A, Jiskoot Wim. Distinct effects of sucrose and trehalose on protein stability during supercritical fluid drying and freeze-drying.[J]. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences, 2006, 27(4):336-45.
[11]Kawai Kiyoshi, Suzuki Toru. Stabilizing effect of four types of disaccharide on the enzymatic activity of freeze-dried lactate dehydrogenase: step by step evaluation from freezing to storage.[J]. Pharmaceutical research, 2007, 24(10):1883-90.
内容丨特种酶研发部
编辑排版丨品牌部审核丨特种酶研发部、品牌部
图片来源丨瀚海新酶
如您有任何疑问,欢迎与我们联系

公司介绍

































