从粗到精——解读mRNA 纯化工艺之道
来源:瀚海生物市场中心 时间:2024-08-27 作者:瀚海新酶 浏览量:245
通过体外转录(IVT)获得的 mRNA,其反应混合物不仅含有所需的 mRNA 产物,还包括蛋白(T7 RNA 聚合酶、无机焦磷酸酶酶)、NTP、模板 DNA、盐离子、各类添加剂以及 IVT 中形成的 mRNA 副产物(dsRNA、截断 RNA 片段)等杂质。这些杂质的存在可能会对 mRNA 的功能产生不利影响,例如影响 mRNA 准确定量、降低其翻译效率或改变免疫原性。因此需要通过纯化技术将目标 mRNA 从 IVT 混合物中分离出,确保其纯度和完整性,保证产品的安全性和有效性。
常见的 mRNA 纯化方式主要有:氯化锂(LiCl)沉淀、硫酸铵沉淀、磁珠纯化、硅胶柱膜纯化和层析纯化等。其中沉淀、磁珠和硅胶柱等方法操作相对简单快捷,但体量小,纯化效率有限,因此多应用于科研和早研应用场景,在工业生产应用场景中,层析纯化是最主要的纯化方法。
氯化锂(LiCl)沉淀法
氯化锂(LiCl)沉淀是一种较为传统的纯化 mRNA 方法。它主要是利用锂离子在特定的 pH 环境下能够减少 RNA 分子之间的同电性相斥,这使得 RNA 分子更容易聚集并形成沉淀。形成的 RNA 沉淀通过离心的方式从溶液中分离出来,得到较为纯净的 RNA 样品。在工业生产中由于残留的锂盐可能具有毒性,且氯化锂沉淀法通常需要在低温条件下对 RNA 进行沉淀,在生产放大时导致较高的能源成本和对设备的特殊要求。通常,对于一些小于 100-200nt 的短片段 RNA 以及浓度较低的 RNA 溶液,该方法无法有效的对其进行沉淀,因此在应用过程中推荐对至少 300nt 以上的片段或者浓度至少 400 µg/ml【1】以上的 RNA 溶液使用该方法,并且由于沉淀出的 mRNA 较难溶解,在复溶时需要注意仔细观察样品是否完全溶解。
硫酸铵沉淀法
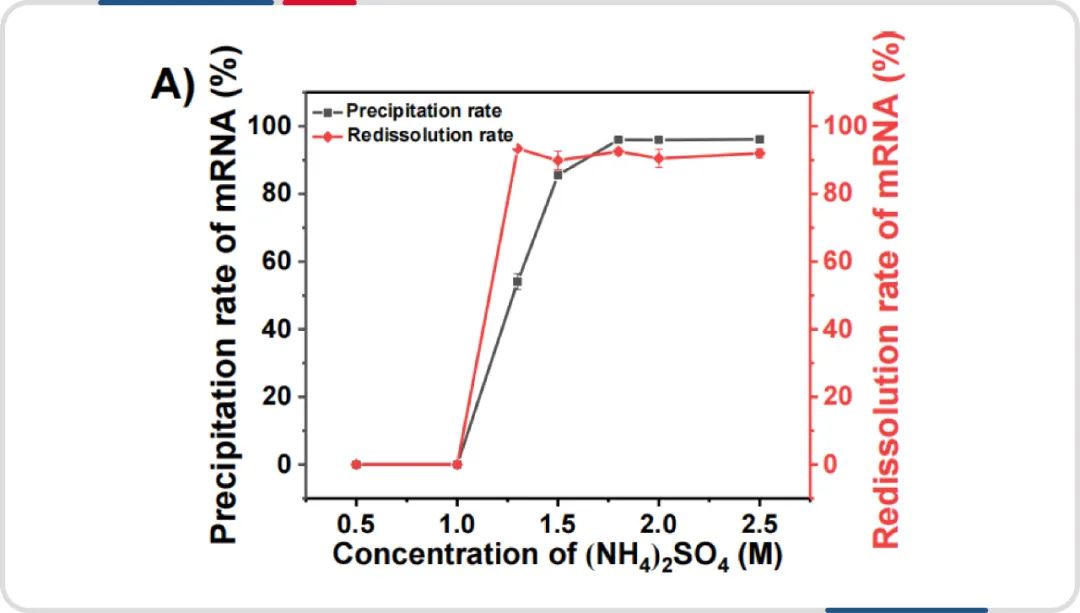
2024 年 1 月中科院过程工程研究所张松平团队发表的题为 “Rapid and high recovery isolation of mRNA from in vitro transcription system by ammonium sulphate precipitation at room temperature” 的文章中探索了硫酸铵沉淀 mRNA 的可行性。
其研究对象为增强型绿色荧光蛋白 (EGFP) 编码的 mRNA,当硫酸铵浓度在 1.8M 时,mRNA 的沉淀率超过了 95%,而当硫酸铵浓度进一步升高时,mRNA 的沉淀速率无显著差异。除了沉淀率外,溶解率也是一个非常重要的指标,它决定了 mRNA 的最终回收率。结果表明,在室温硫酸铵浓度高于 1.8M 时,沉淀物可在 3 min 内迅速溶解在不含 RNase 的水中,溶解率达到 90% 以上。作者推荐最佳沉淀条件为 2M 硫酸铵(AS), pH 7.0,温度 20℃,沉淀时间 2h,可达到近 100% 的沉淀率和近 100% 的溶出率。
硫酸铵及 LiCl 沉淀法对 NTP 的去除率均高于 99.0%,DNA 模板去除率分别约为 82.08% 和 85.88%,T7 聚合酶的去除效率硫酸铵沉淀法则弱于 LiCl。而相较于 LiCl 沉淀,硫酸铵沉淀则可以在室温下进行,使放大生产过程中的应用成为了可能。

硅胶柱膜纯化
硅胶柱膜纯化主要是基于硅胶膜表面的硅醇基团与 mRNA 分子之间的相互作用,硅胶膜表面的硅醇基团呈弱酸性,水化后带负电,在高盐环境下,通过形成阳离子桥,能够中和 mRNA 和硅醇基团之间的表面负电荷,促进硅胶膜上的硅醇基团与 mRNA 的磷酸基团之间的结合,在低盐或水溶液状态下,由于硅胶膜的硅醇基团与 mRNA 磷酸基团之间的静电排斥,硅胶膜释放 mRNA。同时硅胶膜对蛋白质、多糖、脂类等杂质基本不吸附,因此在高速离心过程中,这些杂质被甩出离心柱,从而实现了 mRNA 与杂质的有效分离。硅胶柱膜法使用的材料安全无毒,符合环保理念,有利于保护实验人员的健康和减少环境污染。硅胶柱膜纯化 mRNA 的方法也因其高效、简便的特点,在实验室和早研阶段中中得到了广泛应用。
磁珠法
磁珠法主要带有修饰的氧化铁磁珠颗粒,这些磁珠能与 mRNA 结合并在磁场作用下移动。当磁场撤离后,磁珠易于从溶液中分离出来,从而实现 mRNA 的纯化。用于 mRNA 纯化的官能团通常有两种,一种是含羧基或羟基官能团的磁珠,mRNA 分子在酸性条件下带有负电荷,能够与磁珠表面的官能团通过静电和疏水作用结合,从而实现选择性的富集 mRNA。另一种是利用磁珠表面偶联的亲和配体 Oligo (dT) 与带 Poly(A) 尾的 mRNA 分子之间的特异性结合来富集 mRNA【2-4】。
相较于氯化锂沉淀法,磁珠法纯化理论上能够更有效地去除蛋白、盐离子和其他杂质,从而获得高纯度的 mRNA。但是磁珠表面的疏水作用力,有时会对 mRNA 完整性产生负面影响,尤其在使用羧羟基的核酸提取磁珠时更易出现磁珠纯化受磁珠储存或者使用条件影响较大,在使用磁珠纯化 mRNA 时需注意:(1)避免磁珠冷冻和高速离心,以免对磁珠产生破环;(2)磁珠应在使用前待其温度平衡至室温后再使用,以保证最佳的结合效率;(3)洗涤磁珠用的乙醇-水溶液尽量现用现配,或者注意密封,以免乙醇挥发影响回收效率;(4) 避免磁珠过度干燥,这会导致不可逆聚集,降低洗脱效率。
层析法
目前,工业级别纯化通常使用层析法,以获得更高的核酸质量和产能上限。目前mRNA 纯化主流的方法是 Oligo dT 亲和色谱,而由于 Oligo (dT) 亲和层析与 Poly(A) 尾的杂交无法区分带有 Poly(A) 尾的 ssRNA 和 dsRNA 等杂质,疏水层析、阴离子层析等作为一种精纯的手段,通常会与 Oligo dT 亲和色谱联用。该方法适用于 mRNA 的放大生产,可作为平台化的解决方案。
01 亲和层析
原理同寡聚 (dT) 磁珠法一致,亲和层析法纯化 RNA 的工艺步骤简单可概括为“高盐结合,低盐洗脱”。Oligo dT 填料以聚苯乙烯为基质,表面覆盖大量羟基、官能化聚 (dT) 基团。高盐条件下,盐离子屏蔽同样带负电荷的填料骨架与 mRNA 的静电排斥作用,使得 mRNA 分子和 Oligo dT 柱配基的构象变得松弛,mRNA 的 poly(A) 尾与官能化聚 (dT) 基团碱基配对,形成氢键,从而捕获 mRNA 分子,而缺乏 Ploy(A) 尾的杂质如:游离核苷酸、短链转录本、酶等则无法结合到 Oligo dT 柱上。当缓冲液没有盐时,dT 配基主链上的磷酸根负电荷和 poly (A) 主链上的磷酸根负电荷之间的静电排斥使其远超氢键作用,从而使 mRNA 顺利洗脱下来,收率可高达 90% 以上。
 亲和层析原理
亲和层析原理
在 Oligo dT 亲和层析工艺开发的过程中上样盐离子浓度,pH,温度,缓冲液等都对最终的结果有较大的影响,需要根据 mRNA 序列长度及生产需求做相应的工艺开发。
02 疏水层析
疏水层析根据 mRNA 和其他杂质如蛋白质等的疏水性质的不同来进行有效分离。核酸的平均疏水性较弱,需选择合适的结合盐后来促进 RNA 分子与疏水色谱基质结合,同时使 DNA 模板和 dsRNA 无法结合到疏水色谱柱上。较小的 ssRNA 分子比较大的分子具有较少的疏水结合位点。这使疏水层析具有一定程度的大小选择性,因此不完整的转录物会在完整的 ssRNA 之前洗脱。疏水层析介质容易被 IVT 混合物污染。洗脱后使用 1M NaOH 进行长时间的清洗可以使其恢复到原始状态,但运行中的污垢会影响纯化性能,也因此更适用于精纯步骤。

03 阴离子层析
阴离子层析利用目标 mRNA 和不同杂质之间等电点的不同带来的电荷差异进行 mRNA 纯化。据文献报道传统的交换剂 QA 和 DEAE 树脂在室温下可用于纯化小于 500 个碱基的 RNA[5,6],纯化大片段的 ssRNA 需要将操作温度提高到50-70℃。然而加热会给工艺开发和制造带来负担,瀚海新酶使用阴离子层析柱在常温下可以很好的分离 ssRNA。样品在中性 pH 下结合,采用 pH 梯度洗脱。DNA 与 ssRNA 分离良好。双链 RNA 在 DNA 之后洗脱,但仍早于 ssRNA。需要注意的是洗脱后的 ssRNA 应立即中和。
 使用阴离子层析柱分离 dsRNA 和 ssRNA
使用阴离子层析柱分离 dsRNA 和 ssRNA
蛋白酶K纯化
目前工业端大部分 mRNA 纯化工艺流程为:TFF1-层析-TFF2。TFF1 步骤的目的是减少蛋白, DNA 模板, NTPs 等杂质, 并置换缓冲体系;层析步骤主要是捕获 mRNA 及去除 dsRNA 等杂质;TFF2 步骤的目的是将目标产物置换到最终制剂缓冲液中。但在 IVT 产物质量较高的情况下(完整度高,副产物低),可以采用添加蛋白酶 K+TFF 的工艺进行下游纯化,蛋白酶 K,作为一种高效的广谱丝氨酸蛋白酶,能够有效的去除与核酸结合的蛋白质杂质。由于蛋白酶 K 的分子量约 30KD,TFF 工艺则建议采用 300KD 的孔径更易于去除蛋白酶 K 及 NTPs 等杂质,相较传统工艺,在工艺时间、复杂度、设备等方面都可以极大的节省成本。然而,蛋白酶 K 本身可能具有一定的免疫原性,这可能会影响 mRNA 疫苗的安全性和有效性。所以在实际应用中,如何平衡蛋白酶 K 的添加量显得尤为重要,需在 IVT 后蛋白酶 K 终浓度的添加量进行优化,使其在 37℃ 下孵育可以有效的去除与核酸结合的蛋白质杂质,同时 mRNA 完整度不受影响。同时,瀚海也在开发检测蛋白酶 K 残留的试剂盒,设置定量检测指标保证 mRNA 疫苗的安全性和有效性。
瀚海新酶通过自主开发搭建的平台化 mRNA 纯化工艺,可提供工业级 mRNA 原液定制化生产服务,并且针对不同类型的 mRNA 及需求,提供 mRNA 纯化工艺开发服务。在为某客户进行工艺开发后,成功将客户 mRNA 原液完整度提高了 11.5%,总蛋白残留降至 0.02%。
 为某客户开发 mRNA 纯化工艺案例
为某客户开发 mRNA 纯化工艺案例
同时瀚海新酶开发了的更适用于科研和早研阶段的 mRNA 纯化试剂盒,与工业端主流的层析法相比,在操作上便捷、无需大型设备、工艺时间短,与小试早研阶段主流的氯化锂沉淀法、磁珠法、硅胶柱法等相比,在保持了操作更便捷快速的基础上,还在提高完整度、去除 NTP 等杂质上更有优势。

瀚海新酶提供
全套 mRNA 疫苗&药物相关高性能酶原料、化学底物、IVT 试剂盒及质控试剂盒,拥有自主质粒制备、IVT 工艺开发、mRNA 纯化、LNP 包封及相关质检平台,可为客户提供基于原料的全套解决方案,全面的工艺开发服务,助力客户快速推进新药开发。对于早研阶段客户可提供 CRO 服务、概念验证服务、第三方质检服务及各类成品 mRNA 原液产品,编码蛋白涵盖报告基因、靶点蛋白、基因编辑蛋白和抗原蛋白等。
参考文献
[1]LiCl Precipitation for RNA Purification, Retrieved Jan 8, 2024,
[2]Product of BeyoMag™ RNA Clean Magnetic Beads, Retrieved Jan 8, 2024,
[3]Product of VAHTS RNA Clean Beads, Retrieved Jan 8, 2024,
[4]RNA Clean XP Performance and Data, Retrieved Jan 8, 2024,
[5]D Prazeres, T Schluep, C Coony, Preparative purification of supercoiled plasmid DNA using anion exchange chromatography, J Chromatogr A 806 (1998) 31–45.
[6]J Koubek, KF Lin, YR Chen, RP Cheng, JJT Huang, Strong anion-exchange fast performance liquid chromatography as a versatile tool for preparation and purification of RNA produced by in vitro transcription, RNA 19 (2013) 1449-1459.





 USA
USA








