生物制品质控中容易被忽视的一项,原来是这个!
来源:瀚海生物市场中心 时间:2024-06-14 作者:瀚海新酶 浏览量:243
DNase RNase检测背景
在 mRNA 研究和工艺过程中,原材料、水、缓冲液、耗材表面,都存在大量脱氧核糖核酸酶(DNases)和核糖核酸酶(RNases)残留和污染的可能性。部分工艺过程中也会额外使用 DNase/RNase 去除宿主 DNA/RNA 的残留,很大可能造成 DNase/RNase 的残留。
残留 DNase/RNase 不仅会造成最终成品质量不过关,而且作为杂质进入人体内,有可能引发高强度的免疫原性等反应,引起较严重的安全性风险。
法规中的核酸酶残留控制
不同法规均包含了对核酸酶残留控制的要点:
《中国药典-人用疫苗总论》:对于与疫苗关键质量属性相关的工艺杂质(如细胞基质残留蛋白质和细胞基质残留 DNA,抗生素、核酸酶、残余牛血清等),如因产品特性无法在成品中检测时,应在适当的中间产物(如原液或半成品)取样检测,其检测结果应能准确反映每一成品剂量中的残留水平。
《中国药典-人用基因治疗制品总论》:对于工艺相关杂质,应检测细胞来源的污染物的残留水平,例如来自包装细胞系或细菌的宿主细胞蛋白和宿主细胞 DNA 。对于生产中使用了辅助病毒、质粒 DNA、牛血清、核酸酶、抗生素等的制品,还应分别检测其残留量或残留活性。
《体内基因治疗产品药学研究与评价技术指导原则(试行)》:DNA 类核酸的稳定性相对较好,但剧烈的环境条件和核酸酶暴露仍有可能对 DNA 的高级结构、完整性产生破坏。RNA 类核酸稳定性较差,且对 RNA 酶较为敏感,其生产和贮存应处于严格的无 RNA 酶的环境。
《体外基因治疗产品药学研究与评价技术指导原则(试行)》:慢病毒载体的纯化工艺研究中建议对核酸酶残留、BSA 残留、风险元件残留(如腺病毒 E1 和 SV40LT 抗原序列残留)、质粒 DNA 残留、宿主蛋白残留、宿主 DNA 残留及转染试剂残留等杂质的去除率进行研究。
DNase RNase检测方法进展
核酸酶检测方法有比色法、凝胶电泳法、高效液相色谱分析法、放射性底物分析法、电化学法,其对应的特点如下:
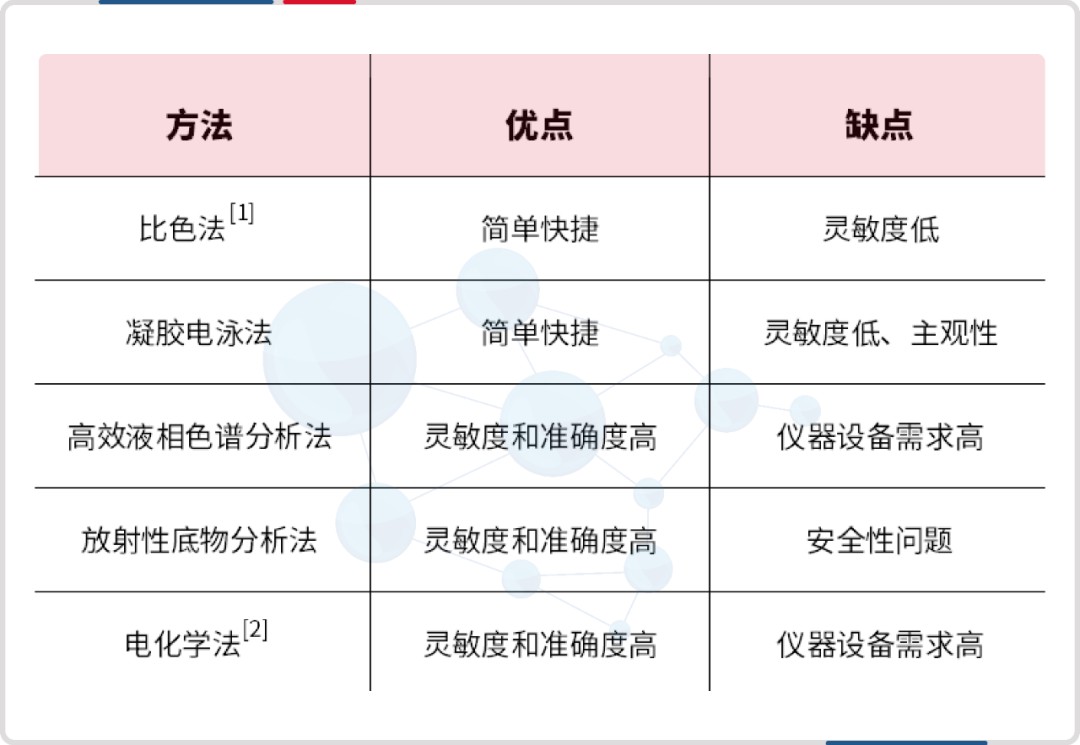
目前最常用的仍是核酸水解凝胶电泳法和紫外分光光度计法。然而核酸水解凝胶电泳法受实验人员的主观判断影响较大,无法准确定量,且操作时间长,测定通量较低。核酸水解紫外分光光度法定量限仅为 0.01U/μL,不适合微量核酸酶残留的活性检测。
相比之下,荧光探针法灵敏度高、检测速度快且能实现核酸酶活性的定量检测,是生物制品的研发及生产过程中 DNase/RNase 残留活性检测的最佳选择之一。
荧光探针法检测DNase和RNase的原理与应用
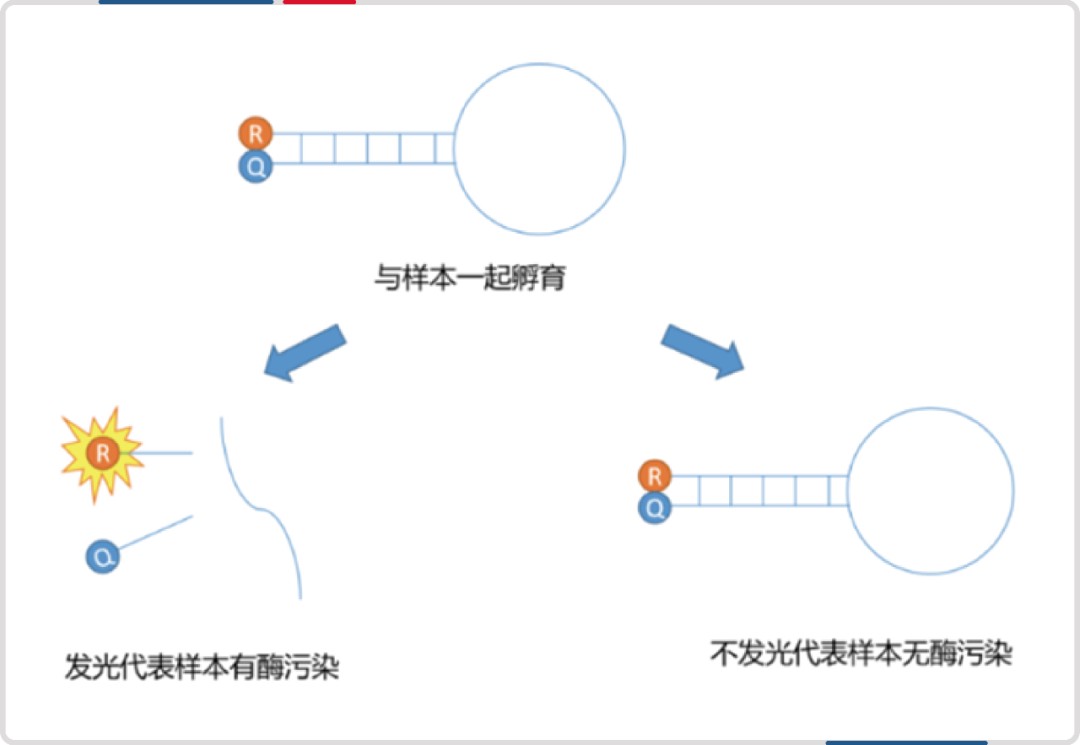
基于核酸荧光底物法的 DNase 和 RNase 检测技术检测原理基本相同:设计出标记有荧光基团的 DNA 探针和 RNA 探针,与测试样本混合。
当样本中不含 DNases 或 RNases 活性,该探针稳定存在,荧光基团和淬灭基团距离较近,由于荧光共振能量转移原理,不会产生荧光信号;
当样本中含有 DNases 或 RNases 活性,探针被降解,荧光基团和淬灭基团相互远离,从而产生逐渐增强的荧光信号;
荧光增加的速率与酶的数量和活性成正相关。
原理如下图所示:
目前,基于核酸荧光底物法的 DNase 和 RNase 检测技术已在多种场合被应用,如致病细菌检测[3-4];监测纳米药物载体在体内的传递和代谢[5];靶向药物筛选[6]等。日本 WAKO 公司分子级别的无核酸酶化学品采用该方法作为质量认证的标准之一[7], 德国 Sartorius 也将该方法作为无核酸酶耗材的质量认证标准[8]。
此外,2023 年 4 月,为进一步提升《中国药典》生物制品标准的科学性,更好地保障生物制品质量,国家药典委员会设立了核酸酶残留量检测方法研究的课题,并在《关于征求核酸酶残留量检测方法验证意见的函》中提出了核酸酶残留量测定法(核酸荧光底物法)的草案,且核酸荧光底物法在海外已用于检测分子生物学环境及试剂中核酸酶残留量。
核酸荧光探针法 DNase 和 RNase 检测技术的认可度正在逐步攀升。
您身边的质控利器
瀚海新酶自主设计研发了基于核酸荧光底物法的DNase 检测试剂盒和 RNase 检测试剂盒。

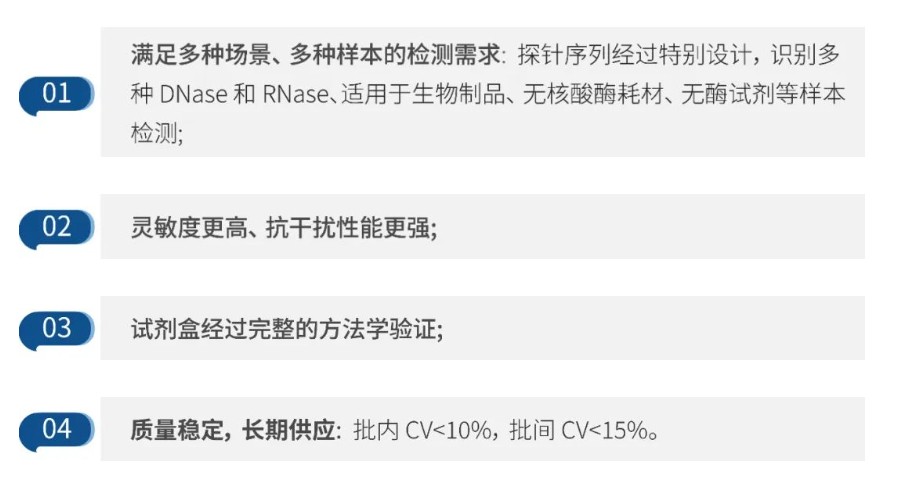
该试剂盒经过特别的序列设计,探针可以分别识别多种 DNase 和 RNase,满足多种场景多种样本的检测需求。
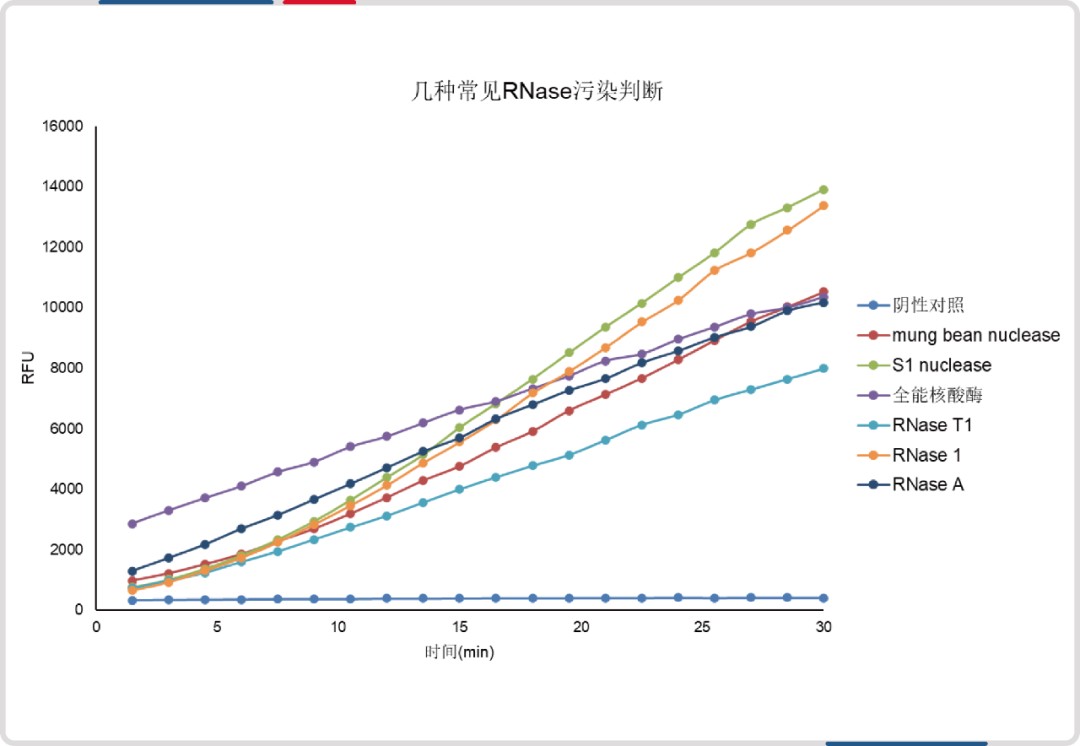
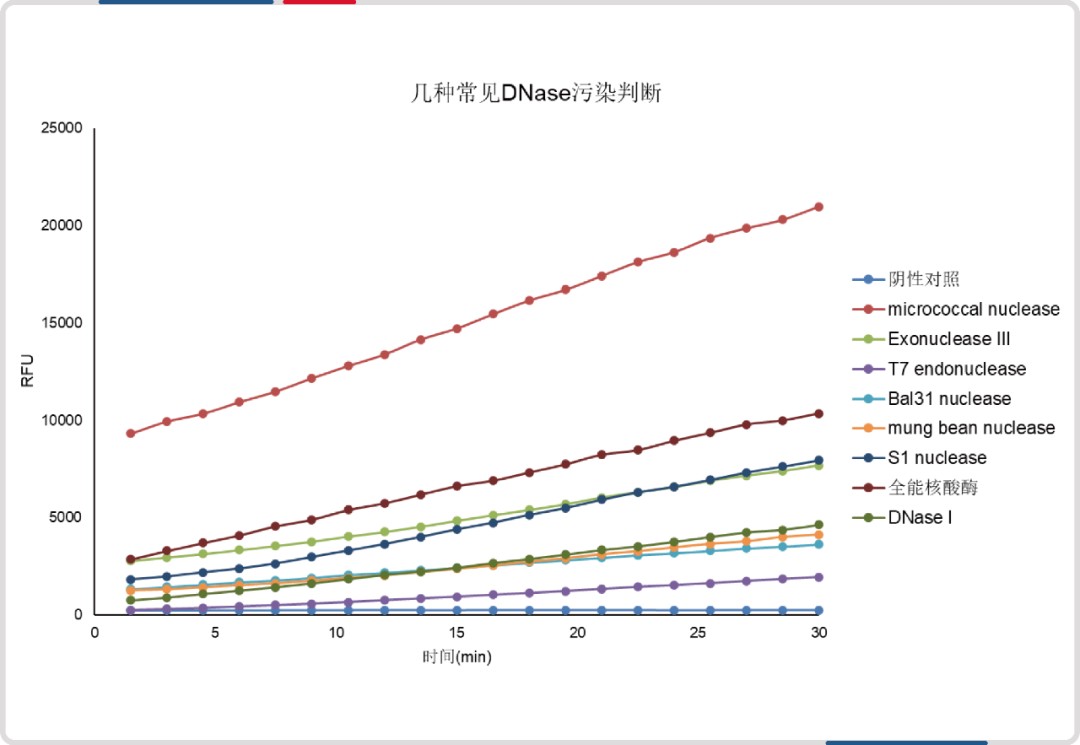
与某进口品牌(荧光探针法)相比,DNase 和 RNase 检测试剂盒最低检出限均低至其 1/8。
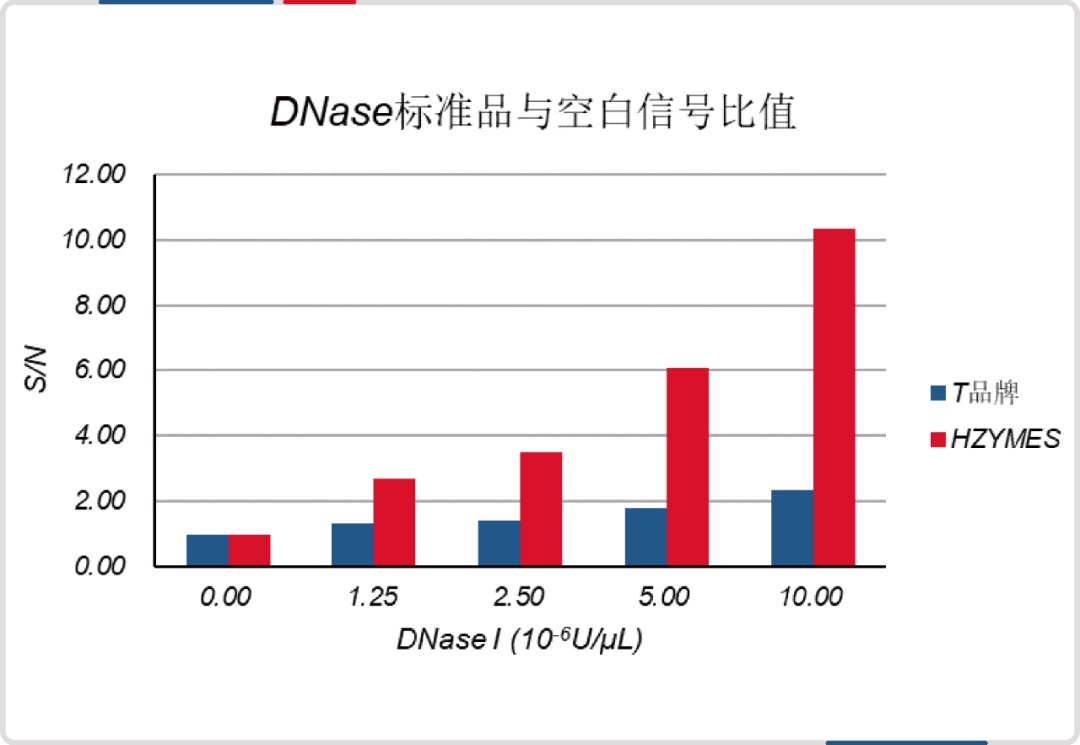
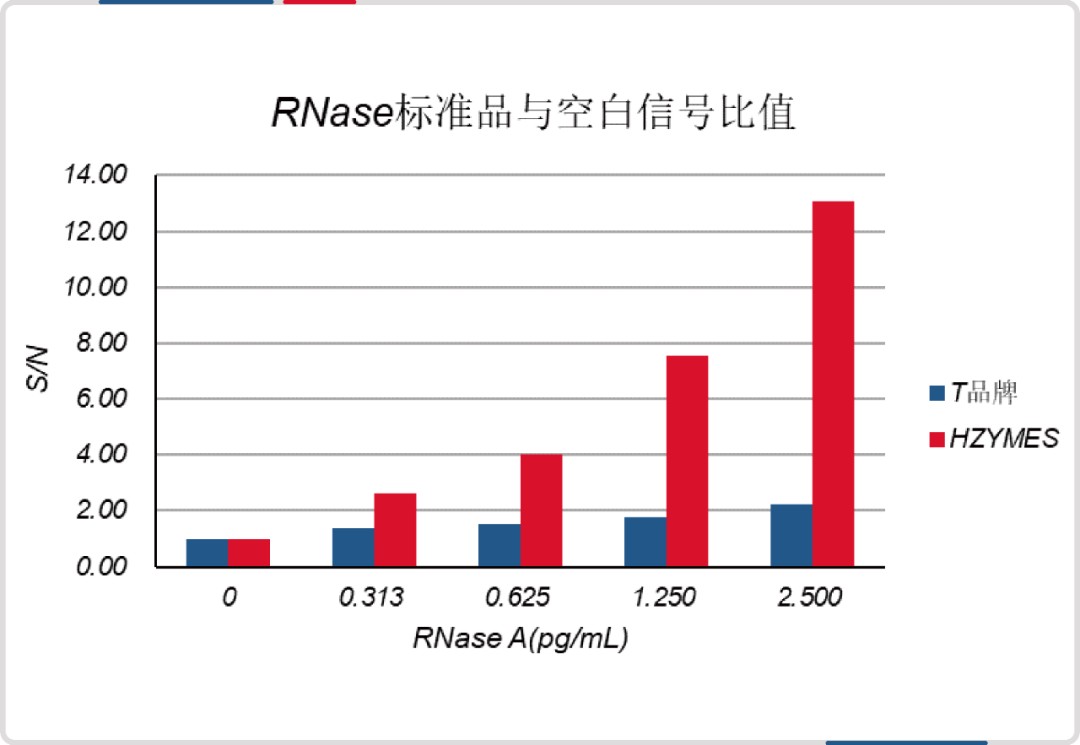
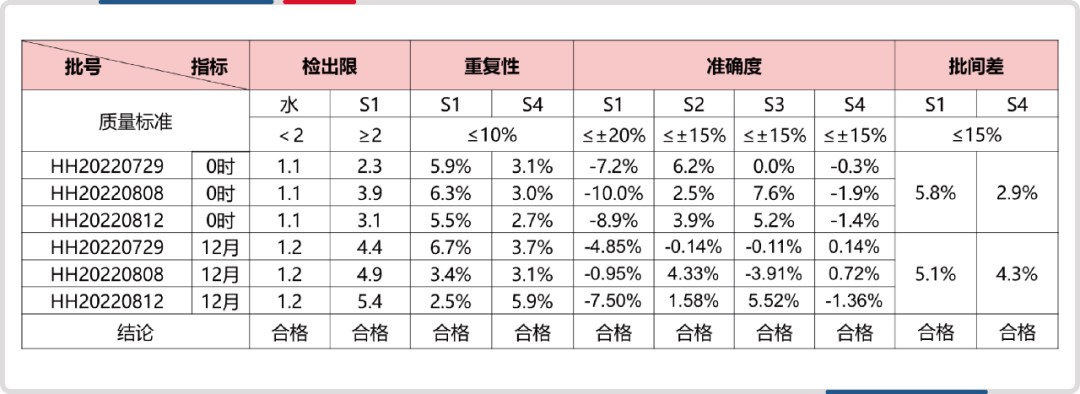
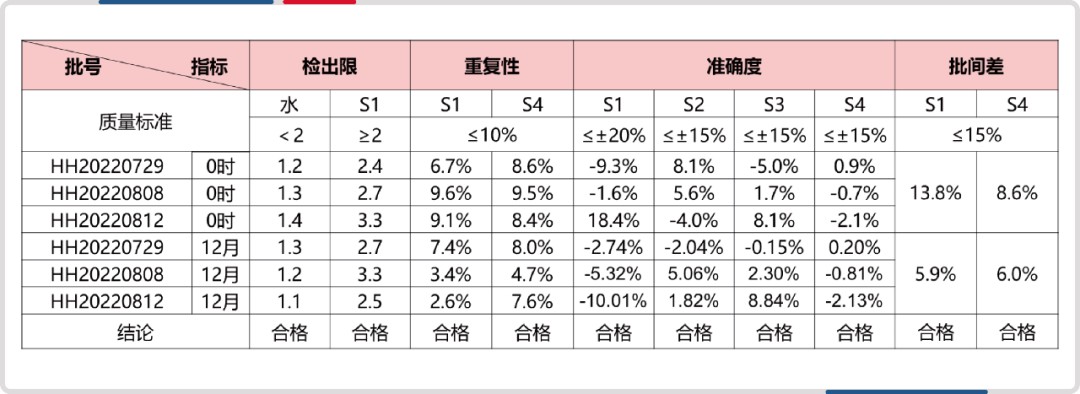
同时,试剂盒已经过完整的方法学验证,质量控制具有保障。
● 抗干扰性能
测试分子实验中常用的缓冲液或物料,瀚海试剂盒干扰物种类更少。
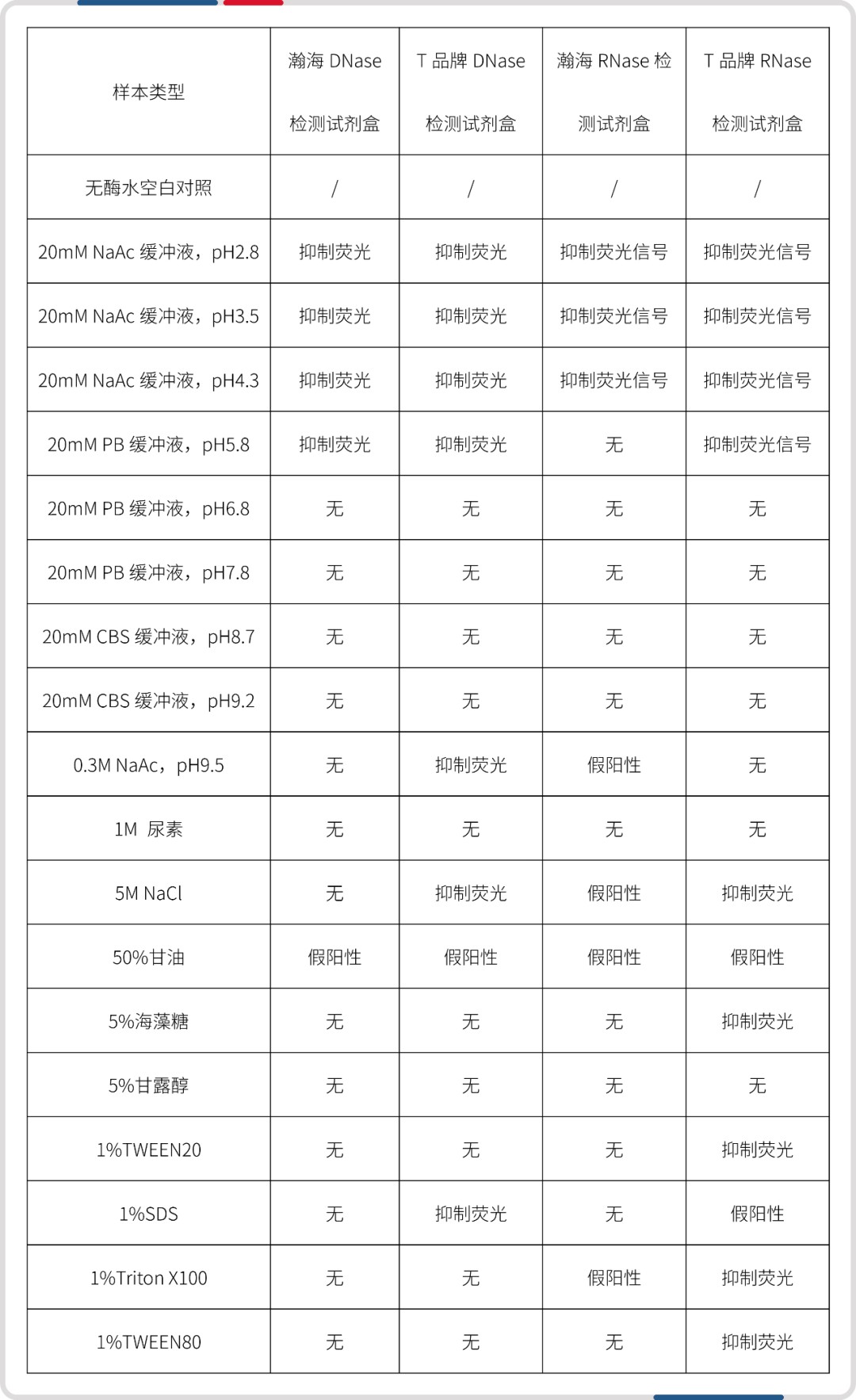
针对部分有干扰物质的样本,可结合实际使用场景,用水稀释后测试。

产品特点
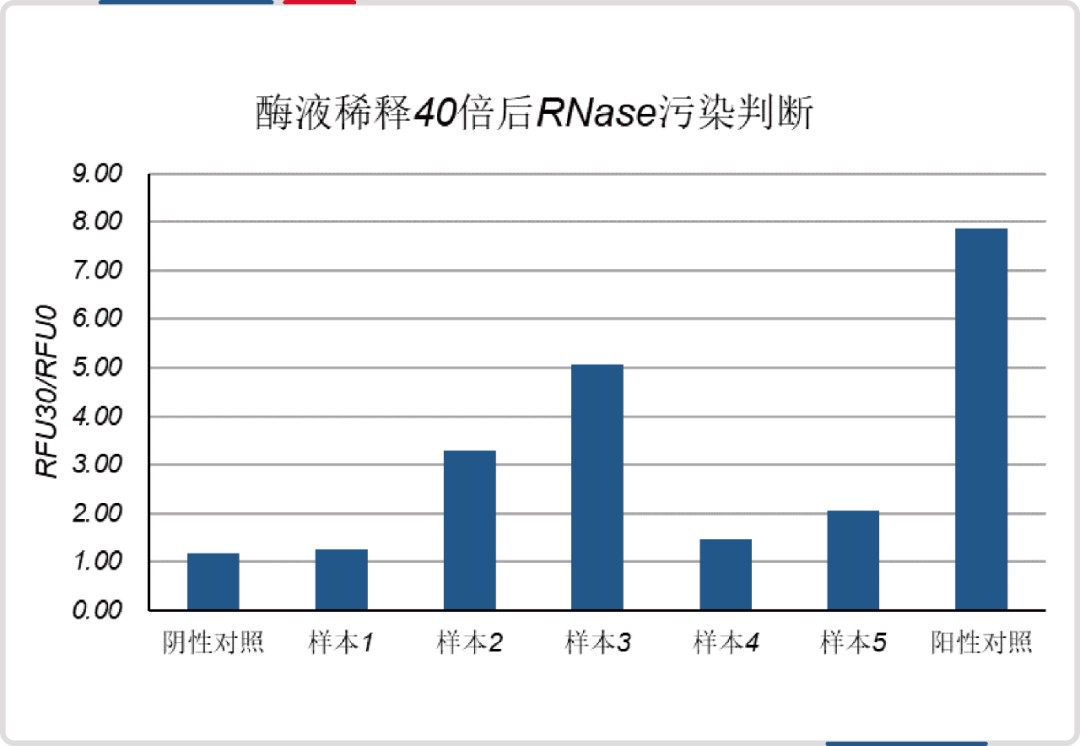
● 真实样本测试案例:
将生物制品研发及生产过程相关的耗材、试剂等作为待测样本,进行测试。
• 1. 一次性无酶多层共挤袋
向多层共挤袋中加入无 DNase 无 RNase 的水,体积为袋标识量的 1/10,盖上盖子,颠倒 20 次,取出水作为待测样本,使用该技术进行定性测试,结果为 3 批次 60 个样本均无 DNase 残留。
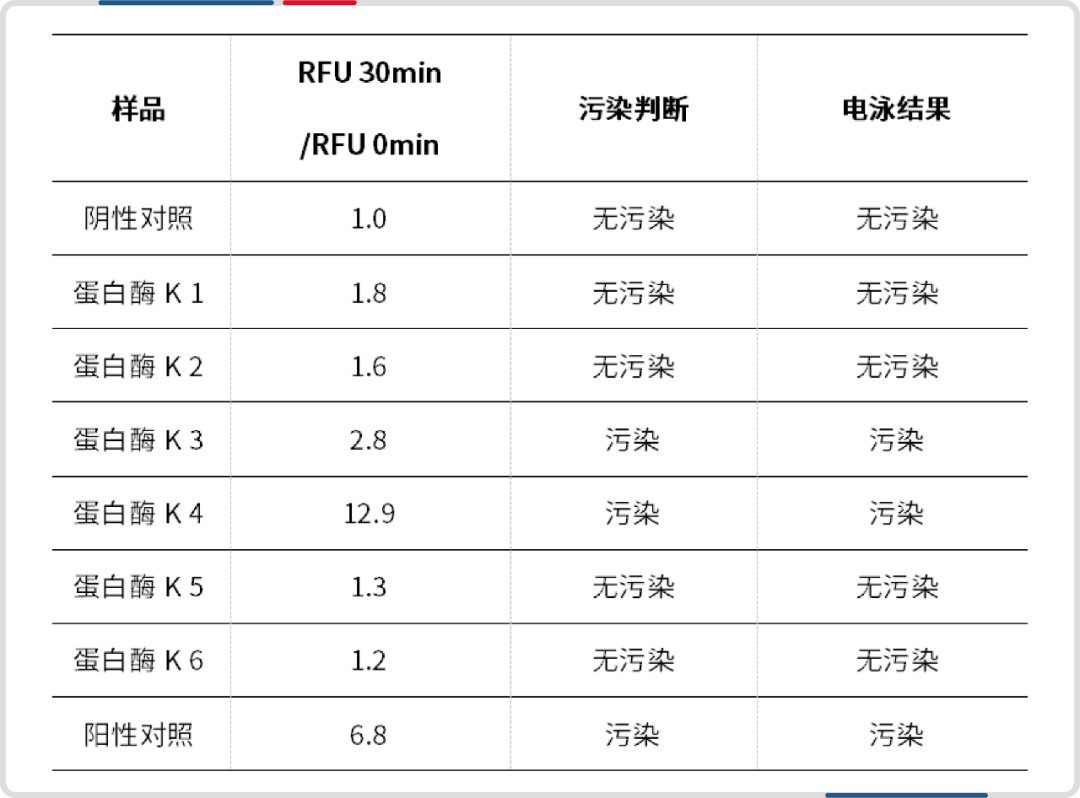
• 2. 不同纯化阶段的蛋白酶K
待测样本分别取自不同纯化阶段,使用该技术进行定性测试,6 个样本测试结果与前期凝胶电泳法结果一致。
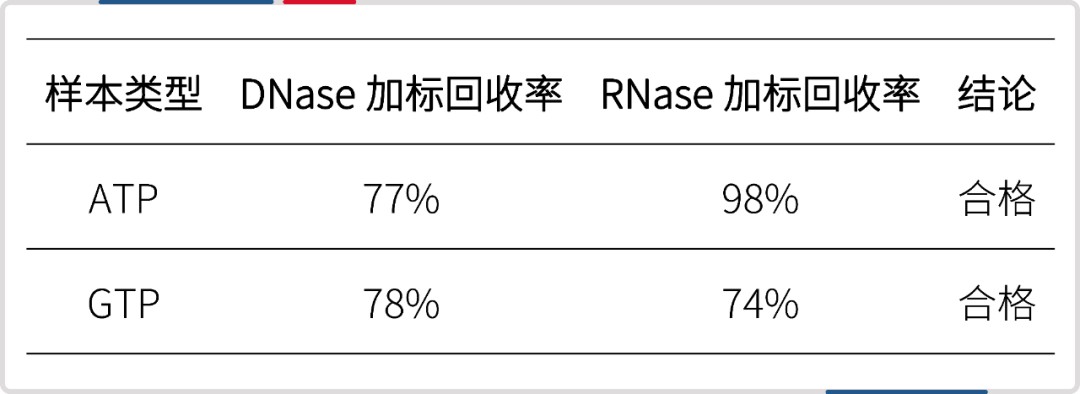
• 3. 核苷酸样本
将 ATP、GTP 用无 DNase 无 RNase 的水稀释至实验常用浓度后作为待测样本,进行加标回收率实验,结果均在 70%~130% 内。
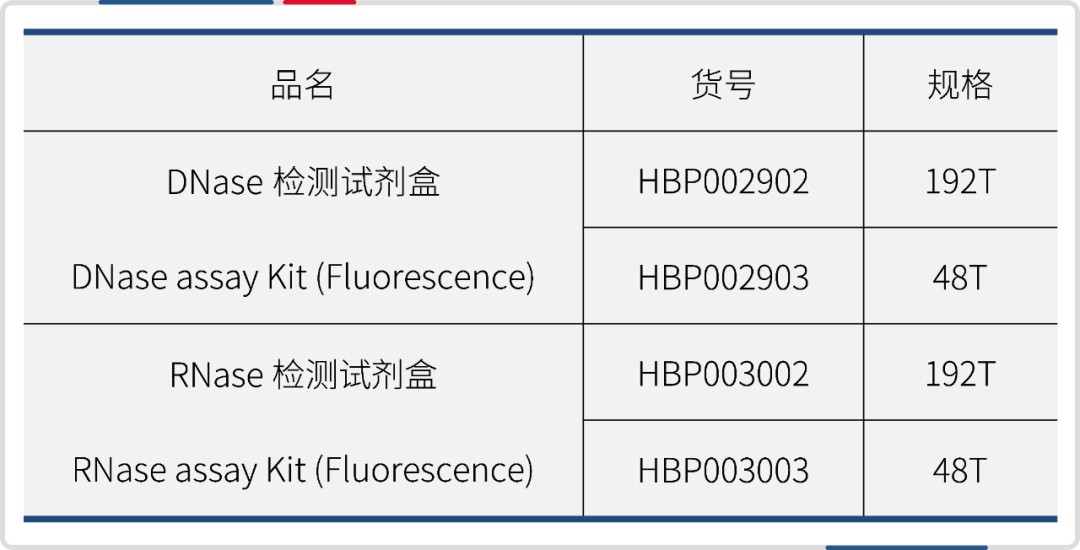
● 产品规格与货号:





 USA
USA








