这个系列HCD试剂盒有多厉害?
来源:瀚海生物市场中心 时间:2024-09-05 作者:瀚海新酶 浏览量:390
宿主细胞DNA的来源
宿主细胞是生物制品的重要基础,许多生物制品如传统疫苗、重组蛋白、抗体药物、细胞治疗、基因治疗、mRNA 相关等,通常以中国仓鼠卵巢细胞 (CHO)、非洲绿猴肾细胞 (Vero)、人胚肾细胞 (HEK 293)、大肠杆菌 (E.coli)、酵母等作为载体进行表达生产。
表达产物在下游纯化的过程中,宿主细胞 DNA (Host Cell DNA,HCD) 通过阴离子交换层析被去除,虽然下游纯化工艺可以去除 HCD 等残留杂质成分,但仍然可能会有部分 HCD 残留,这些残留的外源 DNA 容易引发潜在的免疫原性及安全问题,所以 HCD 检测是生物制品生产工艺中重要的质量检测指标之一。
HCD检测的重要性
宿主细胞残留 DNA 进入体内后容易造成多种后果:
● 致癌性:容易引入显性致癌基因,使得部分细胞分化为瘤性细胞。同时残留的宿主细胞核酸可能会在体内造成细胞增殖失控,变为肿瘤细胞,例如 Ad5E1A、SV40。
● 感染性:宿主细胞 DNA 中可能存在感染性病毒基因,通过复制和转录扩增并产生感染性病毒粒子,例如 HIV-1。
● 增加免疫源性:宿主细胞基因组 DNA 富含 CpG,可能通过 TLR(Toll-like receptors) 介导引发免疫反应。
● 潜在重组风险:宿主细胞基因组内的 LTR 可转移到细胞原癌基因邻近处,使这些原癌基因在 LTR 作用下被激活,将正常细胞转化为癌细胞。
HCD的检测方法
《中国药典》2020 年版,通则 3407 针对外源性 DNA 残留量测定收录了 3 种方法:DNA 探针杂交法、荧光染色法、定量 PCR 法。
DNA探针杂交法
将供试品中的外源性 DNA 加热变性为单链后吸附于固相膜上,与特异性标记的单链 DNA 杂交复性结合为双链 DNA。与已知含量的阳性 DNA 对照比对后,显色深度反应 DNA 量,可测定供试品中外源性 DNA 残留量。
方法特点:
• 当样品 DNA 含量小于 10pg 时,样品中化学物质对检测结果影响很大。
• 检测结果不稳定,与真实宿主细胞残留 DNA 含量有很大差异性,检测时间相对较长。
应用双链 DNA 荧光染料与双链 DNA 结合形成复合物,在 480nm 波长激发下产生荧光信号,使用酶标仪在波长 520nm 处进行检测,在一定的 DNA 浓度范围内,荧光强度与 DNA 浓度成正比。根据标准品和供试品的荧光强度,计算供试品中的 DNA 残留量。
方法特点:
• 荧光信号容易受到干扰,导致特异性变差。
• 必须避免实验耗材和环境的 DNase 污染。
针对宿主细胞 DNA 设计特异性引物和带有荧光标记的探针,反应开始后宿主细胞 DNA 经热变性解链成单链,探针优先跟模板链退火,引物随后退火到模板上进行链的延伸,延伸过程中扩增酶发挥 5’-3’ 外切酶活性,遇到探针会从 5’ 端逐个碱基切除探针,荧光基团会和淬灭基团分开形成游离的荧光信号,被荧光检测系统检测。采用已知浓度的 DNA 标准品,构建标准曲线,测定供试品中外源 DNA 残留量。
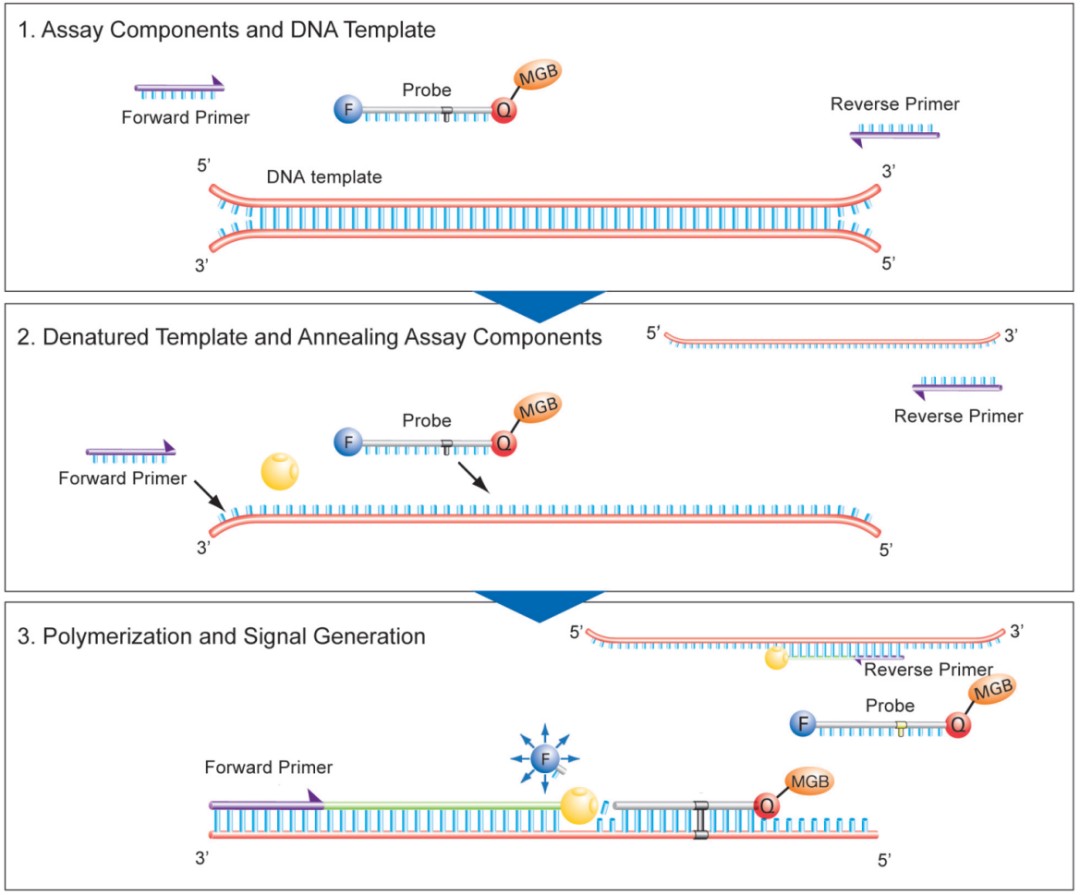
定量 PCR 法是中国药典确认的外源性 DNA 残留测定方法,也是新版 USP 中唯一推荐生物制品中宿主残留 DNA 的检测标准方法。
方法特点:
• 引物和探针特异性的结合目标区域,保证检测结果的准确性和特异性。
• 荧光探针具有更高的灵敏度,针对痕量残留 DNA 进行检测并准确定量。
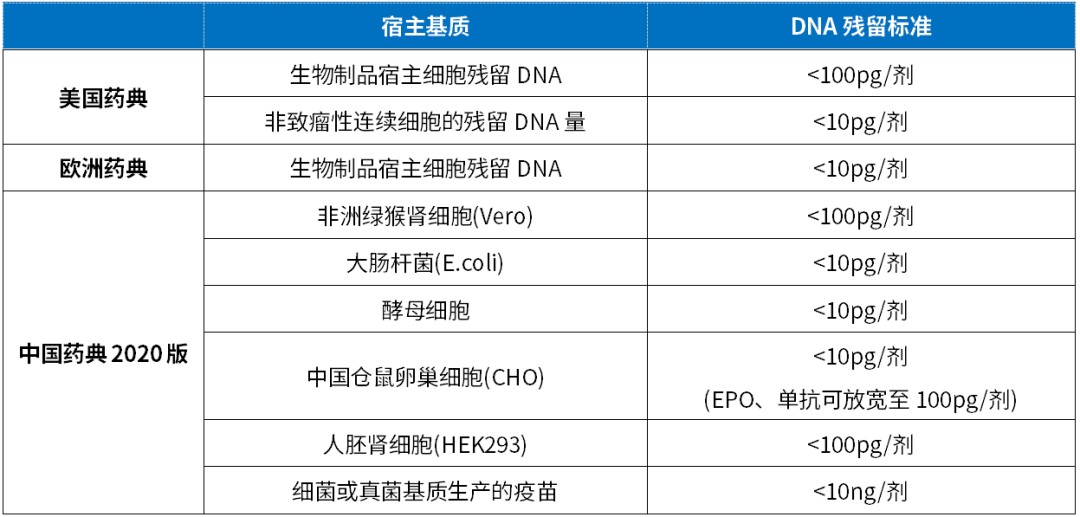
宿主细胞残留DNA标准
产品特点
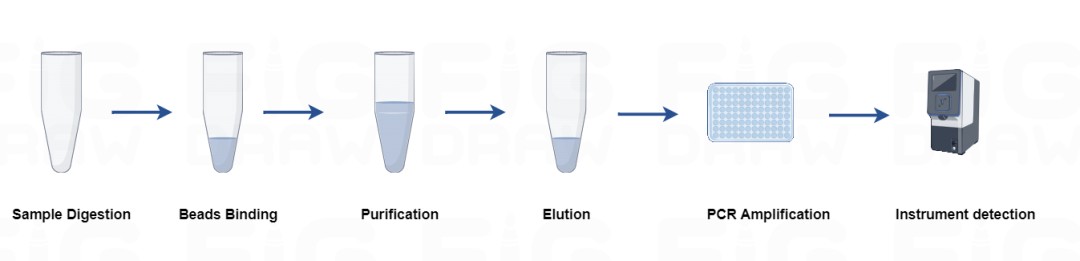
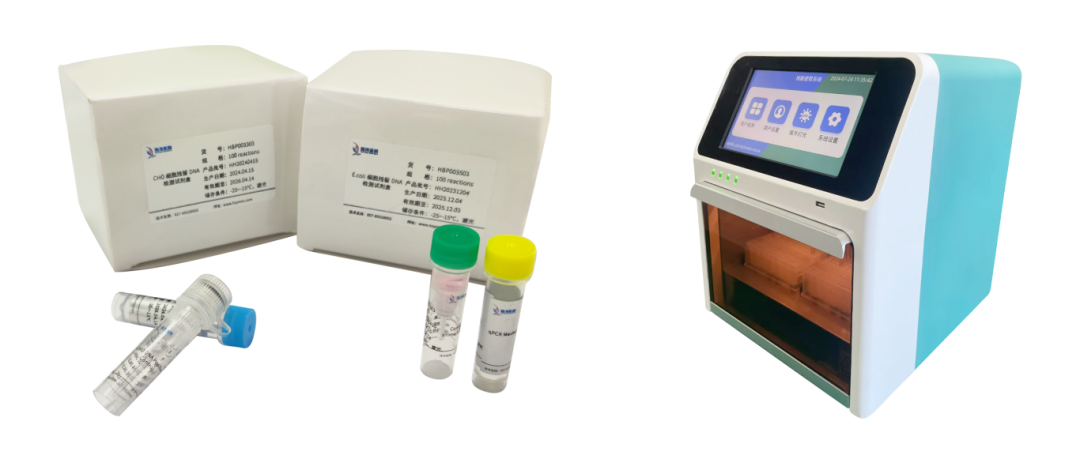
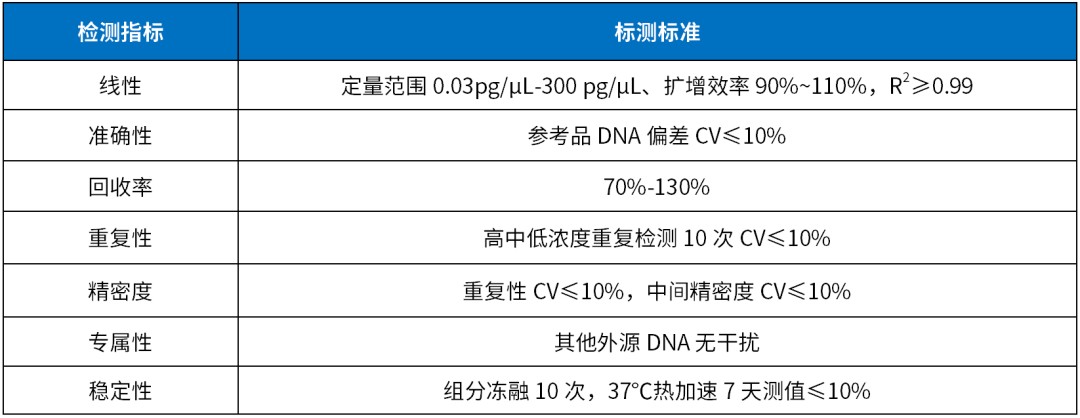
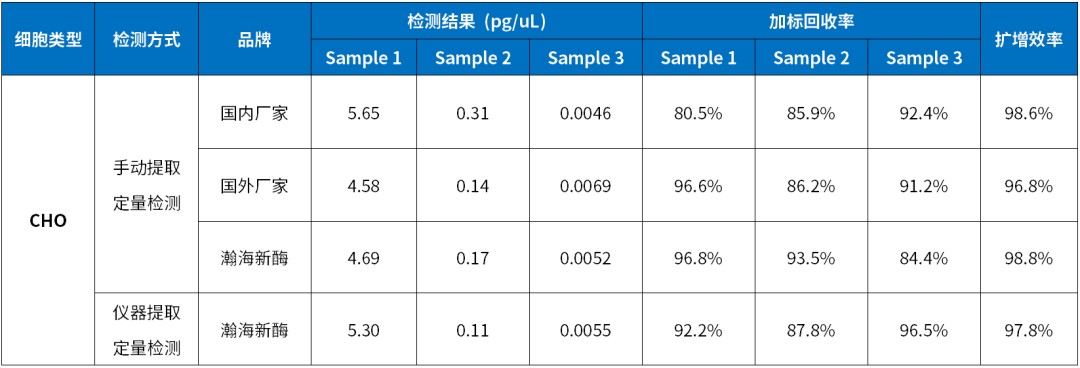
瀚海新酶全新升级宿主残留 DNA 检测产品,覆盖 CHO、E.coli、Vero、HEK293、毕赤酵母、支原体等多个细胞类型。试剂盒引物探针序列出自药典,无需做整套验证实验仅需方法确认即可。根据定量PCR 方法开发,LOD 可达 0.003 pg/μL,与其他 DNA 无交叉反应,减少检测反应的假阳性。严格的生产管理体系,批间差可控 CV<10%。提供手动提取和自动化仪器提取的整套解决方案,2h 内快速完成检测,并保证定量检测的准确性。
性能数据
标准品采用国家标准品标定
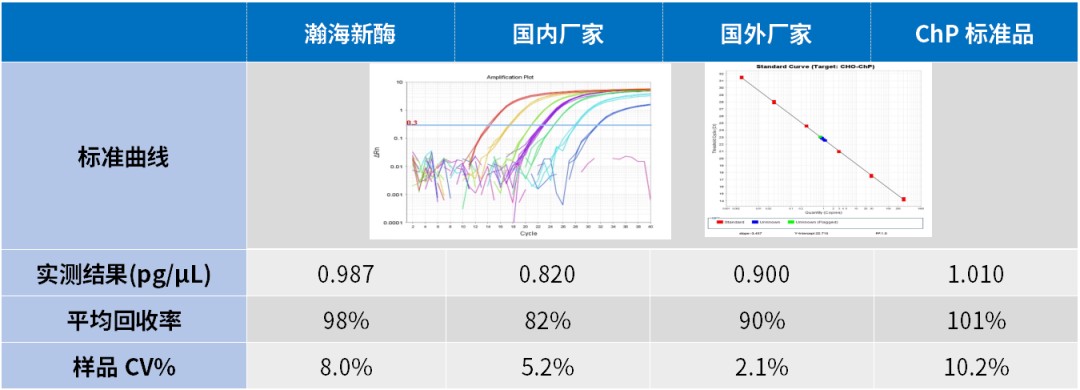
CHO HCD 试剂盒中的标准品采用国家 CHO DNA 标准品标定,使用相同试剂盒检测不同厂家标准品,瀚海新酶标准品的测值偏差小于 5%。

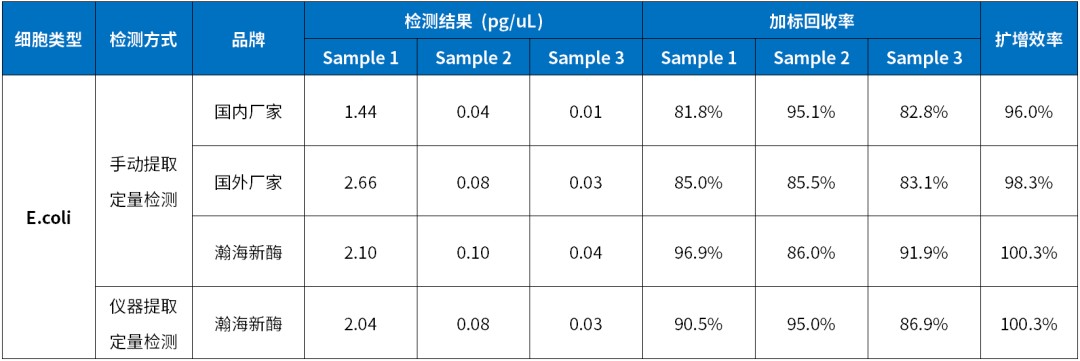
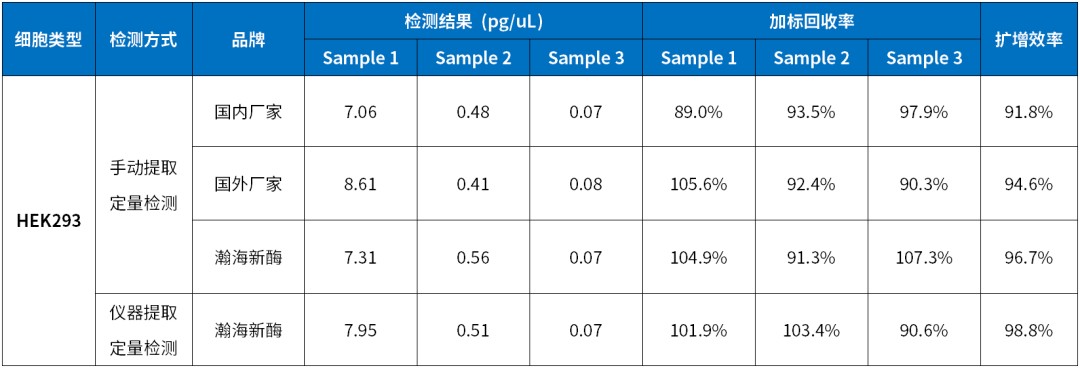
提取试剂成品组装直接使用,无需单独配制试剂,整套室温稳定存放。全自动化仪器提取搭配预封装版试剂盒,灵活按需取用。
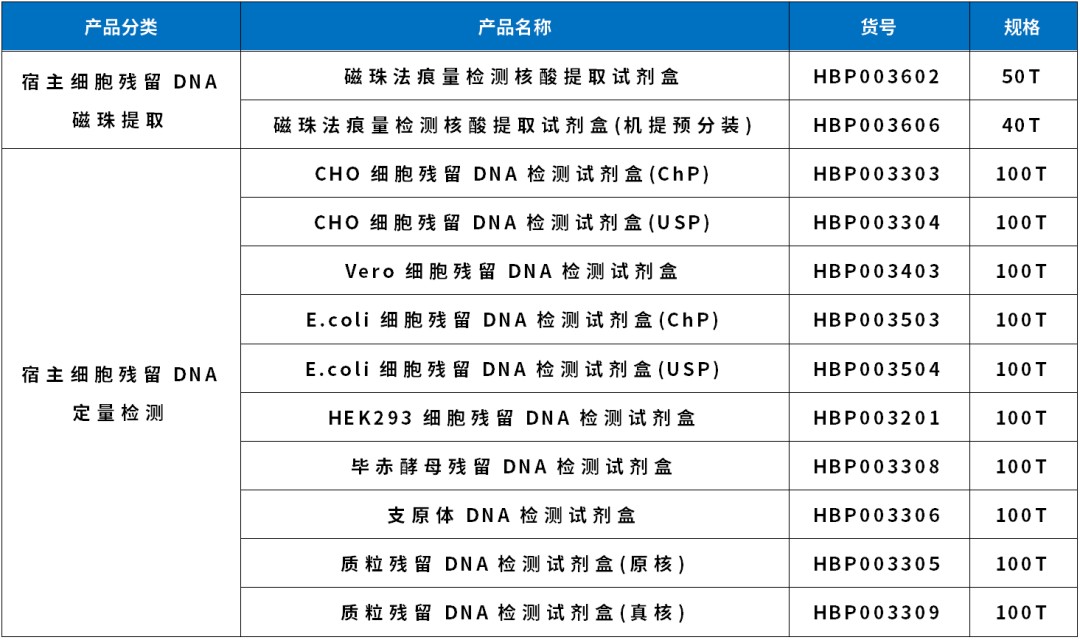
产品信息
[2] 国家药典委员会,中华人民共和国药典(2020年版).
[3] 闫璐瑶 张家友 杨晓明. 生物制品中宿主细胞残留DNA检测的研究进展[J]. 国际生物制品学杂志, 2021, 44(3): 170-174.





 USA
USA








